Bronsted-Lowryn määrittely haposta ja emäksestä: happo luovuttaa protonin (H+), ja emäs vastaanottaa protonin (H+).
Arrheniuksen määrittely: happo tuottaa vesiliuokseen H+ ioneja, ja emäs tuottaa vesiliuokseen OH- ioneja.
Hapot & emäkset kutsutaan protolyyteiksi.
Tarkastellaan vetykloridin (HCl) protolyysireaktiota veden kanssa.
HCl on happo, eli se luovuttaa protonin (H+).
Tarkastellaan ammoniakin (NH3) reaktiota veden kanssa
NH3 on emäs, eli se vastaanottaa protonin vedeltä (H2O).
Tähän asti kaikki ok.
No sitten tarkastellaan kaliumhydroksidin (KOH) reaktio veden kanssa.
KOH on emäs, se kyllä tuottaa OH- ioneja vesiliuoksessa...MUTTA huomaa, että se ei ole vastaanottanut protonin H+. Kumma juttu. Ja muuten vesi (H2O) jätetään reaktiosta pois.
VAHVAT vs HEIKOT
On olemassa vahvoja/ heikkoja happoja sekä vahvoja/ heikkoja emäksiä.
Ero on yksinkertainen:
Vahvat hapot tai emäkset protolysoituvat TÄYSIN.
Eli ensinnäkin nuoli on yhdensuuntainen ;) ja tärkein juttu:
1) Vahvan hapon vesiliuoksissa (H3O+) konsentraatio on sama kuin hapon alkukonsentraatio! Koska happo on täysin protolysoitunut.
2) Vahvan emäksen vesiliuoksissa (OH-) konsentraatio on sama kuin emäksen alkukonsentraatio! Koska emäs on täysin protolysoitunut.
VARO!!! TARKISTA AINA REAKTIOYHTÄLÖN KERTOIMET!!!!
...... juku.Helppo esimerkki ennen kuin jatketaan heikoilla hapoilla/emäksillä.
V: 1L
Sr(OH)2 alkukonsentraatio = 0,1234 mol/l
pOH=?
pKw = pH + pOH
14 = pH + 0,6
pH = 13,4 eli hyvin emäksinen.
********
Vahvojen happojen/emäksien laskut ovat yleensä niin helpot [koska konsentraatiot ovat samat, jos ei kaksinkertaiset], että tehtäviä vaikeutetaan lisäämällä vaikka massaprosenttilaskun, tiheys, paine tai tilavuus... ne ovat kumminkin helposti laskelttavissa kemian peruyhtälöillä. Tarvitaan vain: m =pV, n = m/M, c = n/V, c1.V1 = c2.V2, ja pahimmassa tapauksessa pV = nRT ;) Katsotaan lisää myöhemmin.
*********
Heikot hapot/ emäkset eivät protolysoitu täysin. Ainoastaan osa protolysoituu, niinpä konsentraatiot ovat työläämpiä löytää koska ionien loppukonsentraatiot eivät ole samat kuin happojen/emäksien alkukonsentraatiot.
Heikon hapon protolyysireaktio:
Jokaisella heikoilla emäksellä on oma emäsvakionsa Kb. (b niin kuin base).
Ne löytyy taulukkokirjasta.
Happovakion lauseke:
Katsotaanpas helppo esimerkki:
Laske liuoksen [OH] konsentraatio ja pH.
Kirjoitetaan ensin reaktioyhtälö
Koska (CH3)3N on heikko emäs, haetaan taulukkokirjasta sen emäsvakio
Tehdään se tuttu taulukko, ja kirjoitetaan mitä tiedetään
Eli jos (CH3)3N menettää x, niin (CH3)3NH+ saa x, ja OH- saa myöskin x.
Kirjoitetaan myös loppukonsentraatiot.
Lasketaan lopuksi pH, vaikka hakemalla ensin [H+] konsentraatio.
***************************************************************
Hieman vaikeampi
Kuinka monta millilitraa 40-massaprosenttista suolahappoa (HCl) tarvitaan valmistettaessa 15 litraa suolahappoliuosta, jonka pH =3
HCl tiheys = 1,18 g/ml
Heti alkuun pieni tilannekatsaus:
Ennen panikointia, lasketaan vaikka H+ ionien konsentraatio kun kerran pH on annettu.
Kiva juttu.
HCl on vahva happo, eli se protolysoituu täysin. [HCl] = [H+].
Huvin vuoksi voidaan todistaa sen:
Ok, tiedetään myös että ainemäärä on oltava sama. Lasketaan ainemäärä:
Kun kerran tiedetään ainemäärä, niin voidaan laskea massa:
Huippua, meillä on HCl
massa... ja jos meitä ei oltaisi kiusattu massaprosentilla, niin
käytettäisi tätä massaa. Valitettavasti, meillä on 40-massaprosenttinen HCl liuos. Keskity: me tarvitaan 0,5468 g HCL. Nyt meillä on ainoastaan 40% HCl-liuosta, joka tarkoittaa sitä, että tarvitaan suurempi määrä nykyistä liuosta jotta HCl:n massa vastaisi haluttu määrää 0,5468g.
***************************************************************
Hieman vaikeampi
Muurahaishapon (HCOOH) vesiliuoksen pH = 2,5 ja tilavuus 0,020 l.
Kuinka suuri tilavuus vettä on lisättävä, jotta pH nousee arvoon 3,5?
Tilannekatsaus:
Meillä on siis liuos, joka täytyy laimentaa.
Kun tehtävästä näkee heti että on kaksi tilavuutta, niin voi automaattisesti kirjoittaa yksi kemian perusyhtälöstä: C1.V1 = C2.V2. ( muista että c on ALKUkonsentraatio, ei tasapainokonsentraatio! ja alkukonsentraatiolla tarkoitan sitä, että c1 on konsentraatio ihan alussa ennen kuin mitään on tapahtunut ja c2 on konsentraatio silloin kun vesi on jo lisätty, mutta tasapainoreaktio ei ole vielä tapahtunut 😬Ok tää oli vasta sekavaa. Tällä yhtälöllä saadaan tilavuus V2, joka vastaa siis koko tilavuutta ei kysyttyä tilavuutta. Kysytty tilavuus on V2- V1:sta.
Ok, meillä on jo V1, joudutaan enään hakemaan c1 ja c2!
Meille on annettu pH, siitä tiedetään H+ tasapainokonsentraatio.
Kiva, tehdään sama juttu kuin äsken. Eli talukko...
Ei muuta kuin laskemaan V2
*************************************************************************************
*************************************************************************************
*************************************************************************************


























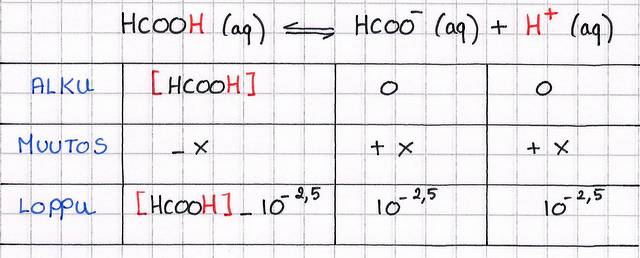






Ei kommentteja:
Lähetä kommentti