Huom! Laskuissa EN HUOMIOI merkitseviä numeroita ;)
Käsitteitä
Käsitteitä
Reaktio voi olla irreversiibeli (palautumaton) esim: rauta reagoi hapen & veden kanssa, ja syntyy ruostetta. Mutta ruoste ei tule palautumaan enää raudaksi.
Reaktio voi myöskin olla reversiibeli (palautuva) jolloin lähtöaineet ei muutu täysin lopputuotteiksi, vaan osa lopputuotteista muutu takaisin lähtöaineiksi! Reaktio pallottelee edes takaisin kunnes, jossain vaiheessa reaktio saavuttaa tasapainotilan.
Tasapainotilassa etenevän ja palautuvan reaktion nopeus on siis yhtä suuri. Lähtö- ja lopputuotteiden konsentraatiot eivät enää muuttu. (huom. lähtöaineiden konsentraatio tasapainotilassa EI ole sama kuin niiden alkuperäinen konsentraatio, koska osa lähtöaineista muuttuu lopputuotteiksi).
Tasapainotila voi olla homogeeninen (aineet samassa muodossa esim ammoniakkisynteesissä kaikki aineet ovat kaasuja) tai heterogeeninen (suljetussa limupullossa kaasumainen CO2 ja veteen liuennut CO2).
Tasapainotila voi syntyä nopeasti tai hitaasti, ja siihen voi vaikuttaa muutamalla olosuhteita (lämpötila, paine, katalyytti).
Reaktion tasapainoasema voi olla lähtö- tai lopputuotteiden puolelle. Eli jos tasapainoasema on lopputuotteiden puolella, on syntynyt enemmän lopputuotetta ;)
Mistä tiedetään missä tasapainoasema on ? No sen kertoo meille K.
K on siis tasapainovakio, jonka arvo kertoo meille tasapainoaseman sijainnin.
Eli jos K on suurempi kuin 1, tasapainoasema on lopputuotteiden puolella (lopputuotteita on enemmän kuin lähtöainetta).
Jos K on pienempi kuin 1, tasapainoasema on lähtöaineiden puolelle (lähtöaineita on enemmän kuin lopputuotetta).
Jos K = 1, niin lähtö- ja lopputuotteita muodostuu yhtä paljon.
Tasapainovakion lauseke:
[C] ja [D] ovat lopputuotteiden konsentraatio tasapainotilassa
[A] ja [B] ovat lähtöaineiden konsentraatio tasapainotilassa.
Esim.
HUOM. lausekkeessa käytetään AINOASTAAN tasapainokonsentraatioita.
(Tietyissä tapauksissa voidaan käyttää ainemäärät, mutta siitä lisää myöhemmin).Miten K lasketaan?
Tärkeä:
*Kirjoita (oikein) tasapainotettu reaktioyhtälö ;) sillähän saat näitä TÄRKEITÄ KERTOIMIA, ja kertoimien suhdetta.
*Selvittelee mitkä ovat loppukonsentraatiot (eli tasapainokonsentraatiot)
Helppo esim:
Lopputuote ammoniakki NH3
Loppukonsentraatiot annettu: [N2]= 0,0510 mol/l
[H2]= 0,1306 mol/l
[NH3]= 0,00281 mol/l
K = ?
mol/l . mol/l
mol/l . mo/l . mol/l . mol/l
Muuten, jos tiedetään etenevän reaktion K niin voidaan helposti laskee palautuvan reaktion K. Se on 1/K
Esim.
Edellisen K arvo oli 0,0695 , niinpä palautuvan reaktion 2NH3 (g) <=> N2 (g) + 3H2 (g) tasapainovakio on 1/ 0,0695.
Mutta siitä lisää myöhemmin.
**************
Hieman vaikeampi
Mitä jos ei tiedetäkään kaikkien aineiden loppukonsentraatioita, miten K lasketaan?
Ei hätää:
Aloitetaan siitä, että kirjoitetaan tasapainotettu reaktioyhtälö.
Selvitetääm alkukonsentraatiot ja tehdään helppo taulukko.
Esim.
Etaanihappo & etanoli reagoivat, muodostuu etyylietanaatti & vettä.
Etaanihapon loppukonsentraatio = 0,25 mol/l
Etanolin lähtökonsentraatio = 1 mol/l
K = ?
Kirjoitetaan taulukkoon mitä tiedetään...
Eli mitä reaktiossa tapahtuu? Lopputuotteita ei tietenkään ole aluksi yhtään. Lähtöaineet alkavat reagoida keskenään, ja muodostavat pikku hiljaa lopputuotteita. Eli lähtöaineista pienenee tietty määrä ja lopputuotteita muodostuu tietty määrä
Nyt tarkkana ;)
Tarkista reaktion yhtälöstä TÄRKEÄT KERTOIMET... huomataan että ne ovat kaikki suhteessa 1.
Kiva!
Se tarkoittaa sitä että yksi mooli CH3COOH ja yksi mooli C2H5OH tuottaa yksi moolia CH3COOC2H5 ja yksi moolia H2O
Lasketaan ekaksi CH3COOH:n konsentraation muutos: 1- 0,25 = 0,75 koska meillä ei ole muutakaan.
Tästä on helppo jatkaa.
Eli jos CH3COOH menettää 0,75, myös C2H5OH menettää 0,75 ja CH3COOC2H5 saa 0,75 ja myös H2O saa 0,75 =)
Ei muuta kuin laskemaan loppukonsentraatiot!
C2H5OH loppukonsentraatio on 1 - 0,75 = 0,25 mol/l
CH3COOC2H5 loppukonsentraatio on 0 + 0,75 = 0,75 mol/l
H2O loppukonsentraatio on 0 + 0,75 = 0,75 mol/l
Loistava! Haetaan vielä K.
K = [CH3COOC2H5] [H2O]
[CH3COOH] [C2H5OH]
K = [0,75 mol/l] [0,75 mol/l]
[0,25 mol/l] [0,25 mol/l]
K = 9 (huom. yksiköt supistuvat pois)
****************************************************************************
Mitä jos kertoimien suhde ei ole 1:1?
Esim.
H2 (g)+ I2 (g) <=> 2HI (g)
Huomataan että yksi mooli vetykaasua ja yksi moolia jodia tuottavat 2 moolia vetyjodidia.
Katsotaanpas esimerkki: [H2] alkukonsentraatio on 1 mol/l
[I2] alkukonsentraatio on 2 mol/l
[HI] loppukonsentraatio on 1,7 mol/l
K =?
Noh, tehdään taulukko. Lopputuotteita (HI) on alussa 0.
Kertoimien suhde mukaan jos H2 menettää x ja I2 menettää x, niin HI saa 2x eikö niin? TAI jos H2 menettää x/2 ja I2 menettää x/2 niin HI saa x se on ehkä helpompaa ;)
H2 menettää x/2 eli 1,7 /2 = 0,85
Samoin I2 menettää x/2 eli 1,7 /2 = 0,85
H2 loppukonsentraatio 1- 0,85 = 0,15 mol/l
I2 loppukonsentraatio 2- 0,85 = 1,15 mol/l
 Loppu on helppo: lasketaan K. Muista kertoimet ja yksikö.
Loppu on helppo: lasketaan K. Muista kertoimet ja yksikö. K = noin 16,7.(yksiköt supistuvat pois)
Tasapainoasema on muuten lopputuotteiden puolella koska K>1.
*******************************************************************************
Mitä jos meillä on palautuva reaktio?
Tässä reaktio H2(g) + I2(g) <=> 2HI(g), jonka K = 4.
Kysymys: Laske palautuvan reaktion eri aineiden tasapainokonsentraatiot kun HI alkukonsentraatio = 2,0 mol/l.
Ensimmäinen asia joka tulee mieleen on se, että tässä varman joutuu käyttämääm 1/K koska niin sanottiin viimeksi että palautuvan reaktion tasapainovakio on 1/K.
Onkin kaksi tapa ratkaista tämän ongelman: käytämällä K TAI 1/K.........juku!
Aloitetaan pikku hiljaa vaikkapa käytämällä 1/K
Taulukko: huom palautuva reaktio!
Eli HI on lähtöaine, H2 ja I2 lopputuotteita!
MUISTA että koska reaktio on palautuva niin K = 1/4 eli 0,25.
Ja H2 sekä I2 ovat nyt lopputuotteita!Eli ovat osoittajassa.
[HI] = 2 - 1 = 1 mol/l
[H2] = 1/2 = 0,5 mol/l
[I2] = 1/2 = 0,5 mol/l
TAI SITTEN KOULUKIRJAN TAPAAN (loogisin ja ehkä helpoin tapa hehheh, tai sitten ei)
Itse en tykkää tästä tavasta..
Eli K pysyy samana = 4, ja EI MUUTETA lähtö-ja lopputuotteiden paikka yhtälössä. Ainoastaan plus ja miinus merkit ovat vaihtaneet paikat, eli palautuvan reaktion suuntaan.
[HI] = 2 - 1 = 1 mol/l
[H2] = 1/2 = 0,5 mol/l
[I2] = 1/2 = 0,5 mol/l
******************************************************************************
CH3OH(aq) + CH3COOH(aq) <=> CH3COOCH3(aq) + H2O(l)
Metanolin alkukonsentraatio 1 mol/l
Etaanihapon alkukonsentraatio 1 mol/l
K = 4
Mikä on metyylietanaatin konsentraatio tasapainotilassa?
Aloitetaan samalla tavalla kuin viimeksi: taulukko.
Eli jos metanoli menettää x, etaanihappo menettää x, niin metyylietanaatti saa x ja vesi saa x.
Ja huvin vuoksi metanolin ja myöskin etaanihapon loppukonsentraatio on 1 - 0,666 = 0,33 mol/l
***************************************************************************
Mitä jos kysytään lähtöaineesta?!?
CH3OH (aq)+ CH3COOH (aq) <=> CH3COOCH3 (aq) + H2O (l)
Kuinka suuri ainemäärä CH3COOH on lisättävä 4 mooliin metyylialkoholia, jotta CH3COOCH3 muodostuisi 2,0 moolia tasapainotilassa ^^
K =4
Woooow aloitetaan!
Taulukko ja nollat:
Mutta mitä me laitetaan CH3COOH kohdalle? Se ei ole nolla, koska pitähän joku aine olla jotta reaktio tapahtu...ja sehän oli kysymyskin, mehän haetaan CH3COOH:n ainemäärä alussa.
 ;) Muuten, miksi me käytetään ainemääriä eikä konsentraatioita? Noh, (niitä ei annettu) =p, tiedetään että konsentraatio c = n/v , jos kirjoitetaan K yhtälö, ja huomioidaan kertoimet (eli 1), huomataan että v supistuu pois.
;) Muuten, miksi me käytetään ainemääriä eikä konsentraatioita? Noh, (niitä ei annettu) =p, tiedetään että konsentraatio c = n/v , jos kirjoitetaan K yhtälö, ja huomioidaan kertoimet (eli 1), huomataan että v supistuu pois.Eli tasapainotila on riipumaton astian tilavuudesta. Voidaan siis käyttää ainemäärät.
Mutta jatketaan: CH3COOH:n ainemäärä kun haetaan niin isketään punaisen x tilalle.
Loputhan on lastenleikkiä! Eli kertoimet, jos CH3OH menettää x, CH3COOH menettää x,ja CH3COOCH3 saa x ja myös H2O saa yhden x.
Huomataan että CH3COOCH3 ainemäärä muutos on 0 + x = 2 eli x = 2
Voidaan laske muidenkin ainemäärät tasapainotilassa.
Ei muuta kuin kirjoitetaan lauseke:
Niinpä n(CH3COOH) = 2,5 mol
****************************************************************************
Mitä jos lisätään lähtöainetta jo tasapainossa olevaan seokseen?
NO2 (g) + SO2 (g) <=> NO (g) + SO3 (g)
Tasapainoseos sisältää: 0,5 moolia NO2
1,0 moolia SO2
4,3 moolia NO
4,3 moolia SO3
* Lisätään seokseen 0,5 moolia NO2
Laske eri aineiden ainemäärät, kun tasapaino jälleen asettuu.
Vai sillä lailla.
Katsotaanpas.... meillähän on jo tasapainokonsentraatiot, mutta siihen lisätään ainetta.... joudutaan siis aloittamaan alusta.
Kaas, taulukko.
Voin käyttää ainemäärät konsentraatioiden sijaan sen takia, että tasapainotila on tässä tapauksessa riippumaton astian tilavuudesta.
Mutta jatketaan, niinkuin reaktiokin:
Ei muuta kuin loppukonsentraatiot.
Noin..... mutta hetkonen...... meiltähän puuttuu jotain!
No K tietysti! eihän me voidaan jatkaa ilman ;)
Ei hätää, lasketaan alkuperäisen reaktion K:ta.
Nyt voidaan jatkaa mistä jäätiin.
Juu, ja siis K pysyy vakiona vaikka muutetaan aineiden konsentraatiota tai ainemäärä! Ainoastaan lämpötilan muutos muuttaa K:n arvoa...mutta siitä lisää Le Châtelier´n periaate osiossa ;)
Uudet ainemäärät:
n(NO2) = 1 - 0,25 = 0,75 mol
n(SO2) = 1 - 0,25 = 0,75 mol
n(NO) = 4,3 + 0,25 = 4,55 mol
n(SO3) = 4,3 + 0,25 = 4,55 mol
Eli AINA kun sorkitaan jotain joka on jo tasapainossa, niin haetaan ekaksi K ja sen jälkeen mikä lie kysytään ;)
***************************************************************************
Mitä jos kysytään tasapainoseoksen uutta tilavuutta muutoksen jälkeen?!?
Taas sorkittiin tasapainoseokseen, se tarkoittaa sitä, että tehtävässä on kaksi vaihetta:
Etsi ensimmäisen reaktion K, ja vasta sitten uusi tilavuus.
Ole tarkkana konsentraatioiden ja ainemäärien kanssa.... ne tuppaavat aiheuttaa virheitä.
Esim.
N2 (g) + 3H2 (g) <=> 2NH3 (g)
Astiaan (tilavuus = 1,0 l) suljettiin N2 (0,015 mol) ja H2 (0,089mol).
a) Mikä on K:n arvo, kun tasapainon asettuessa astiaan muodostuu 0,014 mol NH3? b) Astian tilavuutta muutettiin siten, että NH3 ainemäärä tasapainon jälleen asetettuessa oli 0,020 mol.
Mikä oli uusi tilavuus?
Taulukko
Jos N2 menettää x määrä, H2 menettää 3x, ja NH3 saa 2x. ( TAI jos NH3 saa x, niin N2 menettää x/2, ja H2 menettää 3x/2 kumpi vaan on helpompi. Tässä tehtävässä aion käyttää vaikka molemmat).
NH3 muutoksessa 0 + 2x = 0,014 x = 0,014/2 x = 0,007
Eli N2 menettää 0,007, ja H2 menettää 3.0,007= 0,021
Niinpä N2 loppukonsentraatio on 0,015-0,007 = 0,008 mol/l
H2 loppukonsentraatio on 0,089-0,021 = 0,068 mol/l
 Haetaan helposti K:
Haetaan helposti K:Noin, katsotaanpas kysymys b.
Aloitetaan uudella taulukolla:
HUOM!
Käytetään uudet konsentraatiot! Koska ei tiedetä uusi tilavuus ja c = n/v , niin käytetään n/v.
Loppu on lasten leikkiä ;)
Eli jos N2 menettää x/2, ja H2 menettää 3x/2, niin NH3 saa x.(TAI voi tehdä niin kuin edellinenkin).
NH3 muutoksesta lasketaan x eli x = 0,020 - 0,014 = 0,006 (v:stä ei tarvitse välittää kun lasketaan muutokset, tai voi kirjoittaa vaikka x/v... ihan sama).
Lasketaan muidenkin muutokset.
N2 muutos on 0,006/2 = 0,003
H2 muutos on 3. 0,006/2 = 0,009
Noin.
Ja loppukonsentraatiot
Ja meillähän onkin jo K = 77,9
Uusi tilavuus on noin 0,45 l





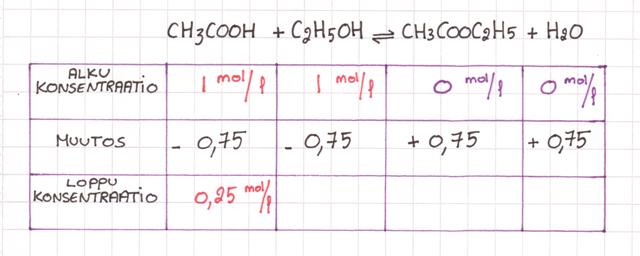





























Ei kommentteja:
Lähetä kommentti