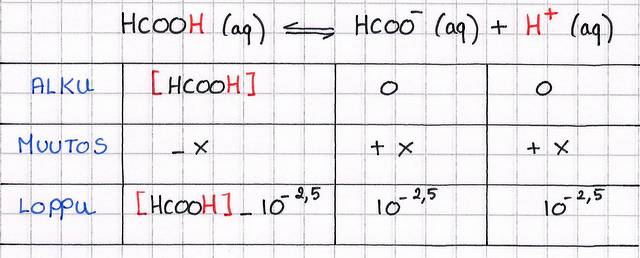Mission Elukka- just my notes
torstai 29. joulukuuta 2011
tiistai 20. joulukuuta 2011
Puskuriliuokset ja Henderson-Hasselbalchin yhtälö
TAI heikosta haposta esim. CH3COOH ja sen vastinemäksestä CH3COO-.
Miten puskuriliuos valmistetaan?
Katsotaanpas ensin se tuttu ammoniakkiliuos. Eli annetaan NH3 liueta veteen.
Onkohan meidän ammoniakkiliuos puskuriliuos?!?
No ei ihan. Koska NH4+ määrä on siinä aivan liian pieni. Sitä pitää lisätä jollain tavalla jotta saadaan puskuriliuos.
Ja kun lisätään NH4+, niin oikeastaan lisätään sen suola muotoa esim. NH4Cl.
NH4+ on kationi, eli sillä on kainalon alla anioni Cl- tasapainottamaan varausta ;)
Puskuriliuos siis koostuu heikosta emäksestä ja suunnilleen samasta määrästä sen suolaa.
TAI heikosta haposta ja suunnilleen samasta määrästä sen suolaa.
Asia selvä. (Tämä on erittäin tärkeää muistaa).
On toinenkin tapa valmistaa puskuriliuos.
Voidaan sekoittaa heikkoa emästä + puolet sen määrästä vahvaa happoa
TAI heikkoa happoa ja puolet sen määrästä vahvaa emästä.
Esim.
Sekoitetaan heikkoa etikkahappoa CH3COOH ja puolet sen määrästä vahvaa emästä NaOH
Jos meillä on alunperin kahdeksan (CH3COOH) molekyyliä, ja lisätään neljä molekyyliä vahvaa (NaOH) niin NaOH protolysoituu täysin ja varastaa hapolta neljä H+ ionia.
Me siis valmistettiin puskuriliuos, jossa on samaa määrä happoa ja sen vastinemästä
Tämä on siis se puskuriliuos eikä se, jossa on heikkoa happoa ja
vahvaa emästä!!!!! Me vaan valmistettiin heikolla hapolla ja vahvalla
emäksellä meidän puskuriliuosta joka siis koostuu HEIKOSTA HAPOSTA JA SEN VASTINEMÄKSESTÄ!
No mitä puskuriliuos sitten tekee?!?
Puskuriliuos estää liuoksen pH:n muutokset esim. jos lisätään pieni määrä happoa tai pieni määrä emästä.
Miten se toimi?
Tämä on hauskaa...
Otetaan esim. puskuriliuos joka koostuu etikkahapposta (CH3COOH) ja sen vastinemäksestä (CH3COO-).
Mitä tapahtuu jos lisätään puskurikiuokseen pieni määrä vahvaa suolahappoa HCL?
No HCl on happo, eli se haluaa luovuttaa protoninsa H+. Ja kuka voi sitä vastaanottaa? Emäs tietysti!
Eli HCl reagoi CH3COO- kanssa.
Ja koska HCl on vahvaa happo, niin se protolysoituu täysin:Huomataan että liuoksesa EI OLE (H+) ioneja jotka tekisivät liuoksesta happaman! Eli pH ei muutu! (tai oikeastaan ei muutu paljon. Ainahan oikeassa elämässä on jonkin verran ioneja lillumassa jotka aiheutavat pieni pH:n muutos).
Verrataan jos samaa HCl reagoisi veden kanssa....täältähän löytyy vaikka kuinka paljon H+ ioneja ;)
Emäs CH3COO- on siis estänyt pH muutoksen vastaanottamalla H+ ionin ja muuttumalla CH3COOH:ksi!
Muuten, uudessa liuoksessa on siis enemmän (CH3COOH) ja vähemmän (CH3COO-), koska HCl käytti osan (CH3COO-):ta. Tämä on TOSI tärkeää ymmärtää, muuten laskut menevät päin p:tä!!!
Kiva.
Kokeillaanpas mitä tapahtuu jos lisätään meidän puskuriliuokseen vahvaa emästä NaOH.
NaOH on emäs, joten se haluaa varastaa protoneita (H+). Eli se tulee reagoimaan tietysti hapon kanssa (CH3COOH). Ja koska se on vahva emäs, niin se protolysoituu täysin.
Huomataan että liuoksessa EI OLE (OH-) ioneja jotka tekisivät liuoksesta emäksisen! Eli pH ei muutu. (Tai ei muutu paljon).
Muista, että uudessa liuoksessa on enemmän (CH3COO-) ja vähemmän (CH3COOH), koska NaOH käytti osan (CH3COOH):ta!
********************************************************************************
vink vink.
Puskuriliuos tehtävissä kysytään yleensä aina liuoksen pH.
On tärkeää muistaa, että puskuriliuos, joka on valmistettu heikosta haposta/emäksestä ja sen vastinsuolasta, sisältää sekä heikkoa happoa/emästä että sen vastinsuolaa, eli taulukossa tarvitaan molempien alkukonsentraatiot. (verrattuna edellisiin tehtäviin, jolloin meillä oli heikko happo/emäs vesiliuoksissa ja vastinemäksen/hapon alkukonsentraatio oli 0!).
Toisin sanoen: ÄLÄ kirjoitaa 0 vastinhapon/emäksen alkukonsentraationa!!!

Jos meillä on puskuriliuos, joka on valmistettu heikosta haposta/emäksestä ja puolet sen määrästä vahvasta emäksestä/haposta, niin silloin vastin hapon/emäksen alkukonsentraatio on 0! Mutta katsotaan se myöhemmin.
Ensimmäinen juttu mitä pitäisi tehdä kun on kyse puskuriliuoksista, on huomioida millä tavalla liuos on tehty, koska laskut ovat hieman erilaisia.
Tässä vaiheessa voin sanoa että aina kuin meillä on valmis puskuriliuos jossa n. puolet-puolet (eli esim. heikkoa happoa ja sen vastinemästä), niin on helpompaa käyttää Henderson- Hasselbalchin yhtälöä ja unohtaa taulukon. Mutta älä hyvä ihminen käytä Henderson-Hasselbalchin yhtälöä kuin päätön kana... varmista että liuos on puskuriliuos, jossa on jäljellä ainoastaan niitä heikkoja happoja/emäksiä.
*********************************************************************
HENDERSON- HASSELBALCHIN YHTÄLÖ
Tätä yhtälöä käytetään jos halutaan skipata taulukko =P
Ja ainoastaan jos meillä on puskuriliuos!
Konsentraatiot ovat alkukonsentraatioita tai ainemäärät.
Toinen muoto, jota ei hirveesti tarvita :
***********************************************************************************
Helppo perustehtävä.
Esim.
HUOM: laskuissa EN huomioi merkitseviä numeroita!
Puskuriliuos v = 1,0 l.
metaanihapon (HCOOH) alkukonsentraatio = 0,02066 mol/l.
Natriumetanaatin (HCOONa) alkukonsentraatio = 0,01133 mol/l.
pH = ?
Meillä on siis puskuriliuos joka on tehty heikosta haposta ja sen vastinsuolasta.
Kirjoitetaan ensin reaktioyhtälö. (Na+) ionista ei tarvitse välittää.
Tapa1.
Metaanihappo on heikko happo, haetaan taulukkokirjasta sen Ka arvo.
Tehdään tuttu taulukko
Haetaan x ja sen kautta pH.
Noin.
Muuten, jos halutaan välttää toisen asteen yhtälöä, niin voidaan jättää pois x:ä hapon ja emäksen loppukonsentraatiosta, koska x:n arvo on sen verran pieni ettei se vaikuta lopputulokseen. (eli voidaan käyttää hapon ja suolan ALKUKONSENTRAATIOT, mutta ainoastaan jos kyse on puskuriliuoksesta joka on tehty heikosta haposta/emäksestä ja sen suolasta!!!).
Esim.
Tapa 2.
Käytetään Henderson-Hasselbalchin yhtälö.
Kas näin.
********************************************************************************
Esim.
Puskuriliuos v = 1,0 l.
c(NH3) = 0,30 mol/l
c(HCl) = 0,14 mol/l
pH = ?
Meillä on siis litran liuos, jossa on heikkoa emästä (NH3) ja vahvaa happoa (HCl). Se EI ole vielä puskuriliuos! (Koska puskuriliuos koostuu heikosta emäksestä ja suunnilleen samasta määrästä sen vastinhaposta).
Nyt mitä tulee tapahtumaan heti alkuun on se, että HCl aikoo reagoida NH3 kanssa.
No mitä sitten??!
Koska HCl on vahva happo, se protolysoituu täysin.
Eli jos HCl ainemäärä oli 0,14 moolia (juu, käytetään mooleja nyt), niin NH3 määrää vähenee 0,14 moolia, ja syntyy 0,14 moolia NH4+.
HCl:stä ei ole enää mitään jäljellä, ja uudessa liuoksessa on vähemmän NH3:sta ja on syntynyt NH4+.
Nyt voidaan kirjoittaa se meidän ainoa oikea puskuriliuoksen reaktioyhtälö:
Ja puskuriliuoksen alkukonsentraatiot. Muuta ei tarvita.
Noin! Pahin on tehty. Nyt vaan löytämään sitä pH arvoa. Näytän kolme tapaa.
Tapa1:
NH3 on heikko emäs, joten haetaan taulukkokirjasta sen Kb arvo.
Edellisessä tehtävässä kerroin että puskuritehtävissä voidaan käyttää alkukonsetraatiot, koska se on helpompaa =) Tällä vältetään toisen asteen yhtälö.
Tapa2:
Käytetään Henderson-Hasselbalch yhtälö:
Muista olla tarkkana: emäs on NH3, ja Ka:n arvo on NH4+:n tasapainovakio.
Tapa3:
#Muista siis käyttää Henderson-Hasselbalch yhtälöä ainoastaan silloin kun puskuriliuos on valmis, eli kun siinä on esim heikkoa happoa ja suunnilleen samaa määrää sen vastinemästä.
#Muista käyttää valmiin puskurin alkukonsentraatioita.

*********************************************************************************
*********************************************************************************
sunnuntai 18. joulukuuta 2011
Protolysoitumisaste
Ok, meillä on vaikka heikko happo vesiliuoksessa:
HA (aq) + H2O (l) <=> A- (aq) + H3O+ (aq)
HA siis protolysoituu osittain, eli osa HA molekyylistä menettää protonin (H+) ja muuttuu A-:ksi.
Protolysoitumisaste on suhde A- konsentraation ja HA:n konsentraation välillä.
[A-] . 100%
Jos protolysoitumisaste on 30 %, se tarkoittaa sitä, että sadasta HA molekyylistä ainoastaan 30 molekyyliä ovat menettäneet protonin ja muuttunut A-:ksi.
Sama juttu jos meillä olisi heikko emäs.
B (aq) + H2O (l) <=> BH+ (aq) + OH- (aq)
[BH+] . 100%
[B]
VARO! Jos tehtävässä kysytään emäsliuoksen protolysoitumisaste..... ja vastaus olisi vaikka 80%, se tarkoittaisi sitä, että sadasta emäsmolekyylistä B, 80 molekyyliä olisi vastaanottanut protonin ja muuttunut BH+:ksi ok?
MUTTA jos kysytään kuinka suuri osuus prosentteina veteen liuenneesta emäksestä on emäsmuodossa, niin se tarkoittaa tietysti ne alkuperäiset 20 molekyyliä jotka ei muuttunut miksikään! Ne ovat siis vieläkin emäsmuodossa (eli B muodossa), ja vastaus olisi 20%.
**********************************************************************************
Tehtävä.
Mikä on ammoniakkiliuoksen konsentraatio, kun sen protolysoitumisaste on 5%?
Ammoniakki (NH3) on heikko emäs , haetaan taulukkokirjasta sen emäsvakio.
Katsotaan mitä voidaan kirjoittaa automaattisesti taulukkoon...
No ei paljon mitään......
Meiltähän puuttuu kaikki konsentraatiot! Ja me tarvitaan ainakin yksi konsentraatio jotta voidaan jatkaa eteenpäin.
Noh, ei me oikeastaan tarvita numeroita, voidaan kirjoittaa vaikka [NH3] alkukonsentraatioksi ja [NH4+] loppukonsentraatioksi.... mutta meillä olisi silti yksi tuntematon liikaa.
Juu, joudutaan heittää [NH4+] menee. ;)
Käytetään protolysoitumisaste apuna
Noin, nyt voidaan kirjoittaa [NH4+] toisin. (Me päästiin eroon toisesta tuntemattomasta).
Taulukko uusiksi
Eli x on [NH3 alku]. 0,05.
Ja loppukonsentraatiot...
Kiva, jospa vaihdan tuo [NH3 alku] vaikka X:ksi niin ei ole niin sekava ;)
Ja tasapainoyhtälö
Noin löydettiin ammoniakkiliuoksen konsentraatio.
HA (aq) + H2O (l) <=> A- (aq) + H3O+ (aq)
HA siis protolysoituu osittain, eli osa HA molekyylistä menettää protonin (H+) ja muuttuu A-:ksi.
Protolysoitumisaste on suhde A- konsentraation ja HA:n konsentraation välillä.
[A-] . 100%
[HA]
Sama juttu jos meillä olisi heikko emäs.
B (aq) + H2O (l) <=> BH+ (aq) + OH- (aq)
[BH+] . 100%
[B]
VARO! Jos tehtävässä kysytään emäsliuoksen protolysoitumisaste..... ja vastaus olisi vaikka 80%, se tarkoittaisi sitä, että sadasta emäsmolekyylistä B, 80 molekyyliä olisi vastaanottanut protonin ja muuttunut BH+:ksi ok?
MUTTA jos kysytään kuinka suuri osuus prosentteina veteen liuenneesta emäksestä on emäsmuodossa, niin se tarkoittaa tietysti ne alkuperäiset 20 molekyyliä jotka ei muuttunut miksikään! Ne ovat siis vieläkin emäsmuodossa (eli B muodossa), ja vastaus olisi 20%.
**********************************************************************************
Tehtävä.
Mikä on ammoniakkiliuoksen konsentraatio, kun sen protolysoitumisaste on 5%?
Ammoniakki (NH3) on heikko emäs , haetaan taulukkokirjasta sen emäsvakio.
Katsotaan mitä voidaan kirjoittaa automaattisesti taulukkoon...
No ei paljon mitään......
Meiltähän puuttuu kaikki konsentraatiot! Ja me tarvitaan ainakin yksi konsentraatio jotta voidaan jatkaa eteenpäin.
Noh, ei me oikeastaan tarvita numeroita, voidaan kirjoittaa vaikka [NH3] alkukonsentraatioksi ja [NH4+] loppukonsentraatioksi.... mutta meillä olisi silti yksi tuntematon liikaa.
Juu, joudutaan heittää [NH4+] menee. ;)
Käytetään protolysoitumisaste apuna
Noin, nyt voidaan kirjoittaa [NH4+] toisin. (Me päästiin eroon toisesta tuntemattomasta).
Taulukko uusiksi
Eli x on [NH3 alku]. 0,05.
Ja loppukonsentraatiot...
Kiva, jospa vaihdan tuo [NH3 alku] vaikka X:ksi niin ei ole niin sekava ;)
Ja tasapainoyhtälö
Noin löydettiin ammoniakkiliuoksen konsentraatio.
***********************************************************************************
***********************************************************************************
***********************************************************************************
lauantai 10. joulukuuta 2011
Heikot/ vahvat hapot ja emäkset, pKa, pKb
(Huom. Laskuissa en huomioi merkitseviä numeroita!)
Bronsted-Lowryn määrittely haposta ja emäksestä: happo luovuttaa protonin (H+), ja emäs vastaanottaa protonin (H+).
Arrheniuksen määrittely: happo tuottaa vesiliuokseen H+ ioneja, ja emäs tuottaa vesiliuokseen OH- ioneja.
Hapot & emäkset kutsutaan protolyyteiksi.
Tarkastellaan vetykloridin (HCl) protolyysireaktiota veden kanssa.
HCl on happo, eli se luovuttaa protonin (H+).
H+ tai H3O+ ionit tekevät vesiliuoksesta happaman.
Tarkastellaan ammoniakin (NH3) reaktiota veden kanssa
NH3 on emäs, eli se vastaanottaa protonin vedeltä (H2O).
OH- ionit tekevät liuoksesta emäksisen.
Tähän asti kaikki ok.
No sitten tarkastellaan kaliumhydroksidin (KOH) reaktio veden kanssa.
KOH on emäs, se kyllä tuottaa OH- ioneja vesiliuoksessa...MUTTA huomaa, että se ei ole vastaanottanut protonin H+. Kumma juttu. Ja muuten vesi (H2O) jätetään reaktiosta pois.
Jokatapauksessa kannattaa muistaa että kaikki alkalimetallit jossa on OH mukana, reagoivat tuolla tavalla vesiliuoksessa. Eli: LiOH, NaOH, KOH...Sekä maa-alkalimetallit jossa on OH mukana kuten Ca(OH)2, Mg(OH)2, Sr(OH)2..... esim:
***************************************************************************
On olemassa vahvoja/ heikkoja happoja sekä vahvoja/ heikkoja emäksiä.
Ero on yksinkertainen:
Vahvat hapot tai emäkset protolysoituvat TÄYSIN.
Eli ensinnäkin nuoli on yhdensuuntainen ;) ja tärkein juttu:
1) Vahvan hapon vesiliuoksissa (H3O+) konsentraatio on sama kuin hapon alkukonsentraatio! Koska happo on täysin protolysoitunut.
2) Vahvan emäksen vesiliuoksissa (OH-) konsentraatio on sama kuin emäksen alkukonsentraatio! Koska emäs on täysin protolysoitunut.
Helppo esimerkki ennen kuin jatketaan heikoilla hapoilla/emäksillä.
V: 1L
Sr(OH)2 alkukonsentraatio = 0,1234 mol/l
pOH=?
Huvin vuoksi voidaan laskea myös pH = ?
pKw = pH + pOH
14 = pH + 0,6
pH = 13,4 eli hyvin emäksinen.
********
Vahvojen happojen/emäksien laskut ovat yleensä niin helpot [koska konsentraatiot ovat samat, jos ei kaksinkertaiset], että tehtäviä vaikeutetaan lisäämällä vaikka massaprosenttilaskun, tiheys, paine tai tilavuus... ne ovat kumminkin helposti laskelttavissa kemian peruyhtälöillä. Tarvitaan vain: m =pV, n = m/M, c = n/V, c1.V1 = c2.V2, ja pahimmassa tapauksessa pV = nRT ;) Katsotaan lisää myöhemmin.
*********
Heikot hapot/ emäkset eivät protolysoitu täysin. Ainoastaan osa protolysoituu, niinpä konsentraatiot ovat työläämpiä löytää koska ionien loppukonsentraatiot eivät ole samat kuin happojen/emäksien alkukonsentraatiot.
Heikon hapon protolyysireaktio:
Heikon emäksen protolyysireaktio:
Jokaisella heikoilla hapolla on oma happovakionsa Ka. (a niin kuin acid).
Jokaisella heikoilla emäksellä on oma emäsvakionsa Kb. (b niin kuin base).
Ne löytyy taulukkokirjasta.
Happovakion lauseke:
Emäsvakion lauseke:
Vesi jätetään lausekkeesta pois, koska melkein koko systeemi koostu vedestä.
Trimetyyliamiini (CH3)3N on heikko emäs. (CH3)3N liuoksen konsentraatio = 0,070 mol/l
Laske liuoksen [OH] konsentraatio ja pH.
Kirjoitetaan ensin reaktioyhtälö
Koska (CH3)3N on heikko emäs, haetaan taulukkokirjasta sen emäsvakio
Tehdään se tuttu taulukko, ja kirjoitetaan mitä tiedetään
Tarkistetaan reaktioyhtälön kertoimet, suhde on 1:1 ;)
Eli jos (CH3)3N menettää x, niin (CH3)3NH+ saa x, ja OH- saa myöskin x.
Kirjoitetaan myös loppukonsentraatiot.
Kirjoitetaan tasapainoreaktion yhtälö
Jep, nyt tiedetään [OH] konsentraatio.
Lasketaan lopuksi pH, vaikka hakemalla ensin [H+] konsentraatio.
Kiva.
Hieman vaikeampi
Kuinka monta millilitraa 40-massaprosenttista suolahappoa (HCl) tarvitaan valmistettaessa 15 litraa suolahappoliuosta, jonka pH =3
HCl tiheys = 1,18 g/ml
Heti alkuun pieni tilannekatsaus:
Ok, tiedetään myös että ainemäärä on oltava sama. Lasketaan ainemäärä:
Lopuksi haetaan kysytty tilavuus:
Jep.
***************************************************************
Muurahaishapon (HCOOH) vesiliuoksen pH = 2,5 ja tilavuus 0,020 l.
Kuinka suuri tilavuus vettä on lisättävä, jotta pH nousee arvoon 3,5?
Tilannekatsaus:
Meillä on siis liuos, joka täytyy laimentaa.
Muurahaishappo on heikko happo, joten etsitään taulukkokirjasta Ka.
Kun tehtävästä näkee heti että on kaksi tilavuutta, niin voi automaattisesti kirjoittaa yksi kemian perusyhtälöstä: C1.V1 = C2.V2. ( muista että c on ALKUkonsentraatio, ei tasapainokonsentraatio! ja alkukonsentraatiolla tarkoitan sitä, että c1 on konsentraatio ihan alussa ennen kuin mitään on tapahtunut ja c2 on konsentraatio silloin kun vesi on jo lisätty, mutta tasapainoreaktio ei ole vielä tapahtunut 😬Ok tää oli vasta sekavaa. Tällä yhtälöllä saadaan tilavuus V2, joka vastaa siis koko tilavuutta ei kysyttyä tilavuutta. Kysytty tilavuus on V2- V1:sta.
Ok, meillä on jo V1, joudutaan enään hakemaan c1 ja c2!
Aloitetaan vaikka c1:stä
Meille on annettu pH, siitä tiedetään H+ tasapainokonsentraatio.
Ok! taulukko esiin...
Noin, ja tiedetään Ka, niin jatketaan vain eteenpäin
Kiva, meillä on siin alkuperäisen liuoksen c1. Meiltä puuttuu enään c2 =)
Mehän tiedetään lopullisen liuoksen pH, joten voidaan hakea H+ tasapainokonsentraatio
Kiva, tehdään sama juttu kuin äsken. Eli talukko...
Ja Ka pysyy samana
Noin saattiin lopullisen liuoksen (HCOOH) alkukonsentraatio.
Ei muuta kuin laskemaan V2
Koska V2 on uuden liuoksen koko tilavuus, ja meiltä kysyttiin kuinka suuri tilavuus on LISÄTTÄVÄ, niin vastaus on siis 1,327 l !
*************************************************************************************
*************************************************************************************
*************************************************************************************
Bronsted-Lowryn määrittely haposta ja emäksestä: happo luovuttaa protonin (H+), ja emäs vastaanottaa protonin (H+).
Arrheniuksen määrittely: happo tuottaa vesiliuokseen H+ ioneja, ja emäs tuottaa vesiliuokseen OH- ioneja.
Hapot & emäkset kutsutaan protolyyteiksi.
Tarkastellaan vetykloridin (HCl) protolyysireaktiota veden kanssa.
HCl on happo, eli se luovuttaa protonin (H+).
Tarkastellaan ammoniakin (NH3) reaktiota veden kanssa
NH3 on emäs, eli se vastaanottaa protonin vedeltä (H2O).
Tähän asti kaikki ok.
No sitten tarkastellaan kaliumhydroksidin (KOH) reaktio veden kanssa.
KOH on emäs, se kyllä tuottaa OH- ioneja vesiliuoksessa...MUTTA huomaa, että se ei ole vastaanottanut protonin H+. Kumma juttu. Ja muuten vesi (H2O) jätetään reaktiosta pois.
VAHVAT vs HEIKOT
On olemassa vahvoja/ heikkoja happoja sekä vahvoja/ heikkoja emäksiä.
Ero on yksinkertainen:
Vahvat hapot tai emäkset protolysoituvat TÄYSIN.
Eli ensinnäkin nuoli on yhdensuuntainen ;) ja tärkein juttu:
1) Vahvan hapon vesiliuoksissa (H3O+) konsentraatio on sama kuin hapon alkukonsentraatio! Koska happo on täysin protolysoitunut.
2) Vahvan emäksen vesiliuoksissa (OH-) konsentraatio on sama kuin emäksen alkukonsentraatio! Koska emäs on täysin protolysoitunut.
VARO!!! TARKISTA AINA REAKTIOYHTÄLÖN KERTOIMET!!!!
...... juku.Helppo esimerkki ennen kuin jatketaan heikoilla hapoilla/emäksillä.
V: 1L
Sr(OH)2 alkukonsentraatio = 0,1234 mol/l
pOH=?
pKw = pH + pOH
14 = pH + 0,6
pH = 13,4 eli hyvin emäksinen.
********
Vahvojen happojen/emäksien laskut ovat yleensä niin helpot [koska konsentraatiot ovat samat, jos ei kaksinkertaiset], että tehtäviä vaikeutetaan lisäämällä vaikka massaprosenttilaskun, tiheys, paine tai tilavuus... ne ovat kumminkin helposti laskelttavissa kemian peruyhtälöillä. Tarvitaan vain: m =pV, n = m/M, c = n/V, c1.V1 = c2.V2, ja pahimmassa tapauksessa pV = nRT ;) Katsotaan lisää myöhemmin.
*********
Heikot hapot/ emäkset eivät protolysoitu täysin. Ainoastaan osa protolysoituu, niinpä konsentraatiot ovat työläämpiä löytää koska ionien loppukonsentraatiot eivät ole samat kuin happojen/emäksien alkukonsentraatiot.
Heikon hapon protolyysireaktio:
Jokaisella heikoilla emäksellä on oma emäsvakionsa Kb. (b niin kuin base).
Ne löytyy taulukkokirjasta.
Happovakion lauseke:
Katsotaanpas helppo esimerkki:
Laske liuoksen [OH] konsentraatio ja pH.
Kirjoitetaan ensin reaktioyhtälö
Koska (CH3)3N on heikko emäs, haetaan taulukkokirjasta sen emäsvakio
Tehdään se tuttu taulukko, ja kirjoitetaan mitä tiedetään
Eli jos (CH3)3N menettää x, niin (CH3)3NH+ saa x, ja OH- saa myöskin x.
Kirjoitetaan myös loppukonsentraatiot.
Lasketaan lopuksi pH, vaikka hakemalla ensin [H+] konsentraatio.
***************************************************************
Hieman vaikeampi
Kuinka monta millilitraa 40-massaprosenttista suolahappoa (HCl) tarvitaan valmistettaessa 15 litraa suolahappoliuosta, jonka pH =3
HCl tiheys = 1,18 g/ml
Heti alkuun pieni tilannekatsaus:
Ennen panikointia, lasketaan vaikka H+ ionien konsentraatio kun kerran pH on annettu.
Kiva juttu.
HCl on vahva happo, eli se protolysoituu täysin. [HCl] = [H+].
Huvin vuoksi voidaan todistaa sen:
Ok, tiedetään myös että ainemäärä on oltava sama. Lasketaan ainemäärä:
Kun kerran tiedetään ainemäärä, niin voidaan laskea massa:
Huippua, meillä on HCl
massa... ja jos meitä ei oltaisi kiusattu massaprosentilla, niin
käytettäisi tätä massaa. Valitettavasti, meillä on 40-massaprosenttinen HCl liuos. Keskity: me tarvitaan 0,5468 g HCL. Nyt meillä on ainoastaan 40% HCl-liuosta, joka tarkoittaa sitä, että tarvitaan suurempi määrä nykyistä liuosta jotta HCl:n massa vastaisi haluttu määrää 0,5468g.
***************************************************************
Hieman vaikeampi
Muurahaishapon (HCOOH) vesiliuoksen pH = 2,5 ja tilavuus 0,020 l.
Kuinka suuri tilavuus vettä on lisättävä, jotta pH nousee arvoon 3,5?
Tilannekatsaus:
Meillä on siis liuos, joka täytyy laimentaa.
Kun tehtävästä näkee heti että on kaksi tilavuutta, niin voi automaattisesti kirjoittaa yksi kemian perusyhtälöstä: C1.V1 = C2.V2. ( muista että c on ALKUkonsentraatio, ei tasapainokonsentraatio! ja alkukonsentraatiolla tarkoitan sitä, että c1 on konsentraatio ihan alussa ennen kuin mitään on tapahtunut ja c2 on konsentraatio silloin kun vesi on jo lisätty, mutta tasapainoreaktio ei ole vielä tapahtunut 😬Ok tää oli vasta sekavaa. Tällä yhtälöllä saadaan tilavuus V2, joka vastaa siis koko tilavuutta ei kysyttyä tilavuutta. Kysytty tilavuus on V2- V1:sta.
Ok, meillä on jo V1, joudutaan enään hakemaan c1 ja c2!
Meille on annettu pH, siitä tiedetään H+ tasapainokonsentraatio.
Kiva, tehdään sama juttu kuin äsken. Eli talukko...
Ei muuta kuin laskemaan V2
*************************************************************************************
*************************************************************************************
*************************************************************************************
Tilaa:
Blogitekstit (Atom)